君實生物近萬字長文逐條迴應質疑!三大要點在這裡
一篇自媒體報道將君實生物推上了“風口浪尖”。爲此,公司昨日先後通過早間聲明、H股公告、電話會議等,積極迴應市場關切,消除投資者疑慮。
11月13日晚間,君實生物又發佈公告回覆上交所問詢,就相關報道涉及的“三大疑點”逐一進行解答。
釋疑要點搶先看:
1、君實生物的特瑞普利單抗不良反應發生率在同類藥物中均處於較低的水平,顯示出良好的安全性和耐受性。
2、目前,JS016在國內外的臨牀進展以及該項目和禮來製藥的合作一切順利。
3、截至2020年11月12日,公司620名研發人員中,本科及碩士學歷547人(佔比88.23%), 博士學歷35人(佔比5.65%),大專學歷等38人(佔比6.13%)。員工學歷的高低與工作能力、實踐經驗也並不是絕對必然的聯繫,上述人員爲公司日常技術活動的開展也提供了較好的輔助。
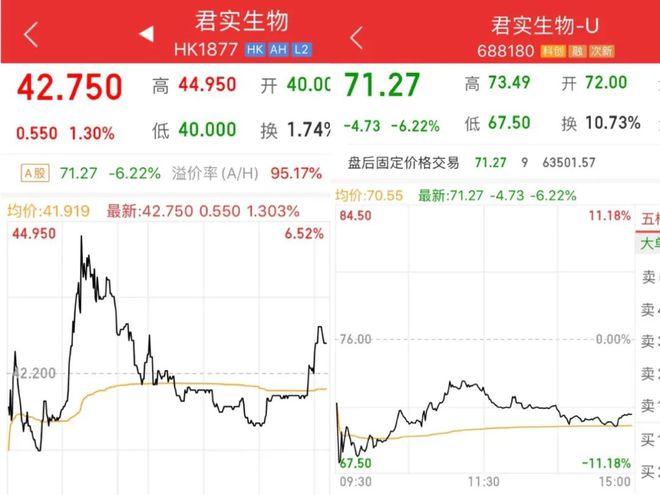
而就在昨日早間,君實生物已率先發布聲明稱:“經過覈實確認,自媒體報道內容全面失實,與客觀事實嚴重不符。”隨後,公司董事長熊俊帶領核心管理層召開電話會議,在線與投資者互動問答。隨着公司高管透露快速、主動釋疑,公司H股股價應聲上漲,盤中最高漲幅6%左右,收盤漲幅爲1.3%;當日A股股價則一直在低位徘徊,最終報收71.27元,跌幅6.22%。可見此次輿論風波對公司股價產生了一定的“殺傷力”,也讓投資者對“吃新藥”心有餘悸。
不過,隨着公司通過明定義、列數據、作對比、擺事實的方式快速回應質疑,外界對於公司及所處產業也會有更加客觀、全面的認識。
安全性、有效性:用數據說話
“所有不良反應發生率爲97.7%”,是公衆號文章對君實生物特瑞普利單抗安全性質疑的關鍵一環。對此,君實生物在回覆問詢中率先說明“所有不良發生率”的具體含義。
根據《藥品臨牀試驗管理規範》(GCP),藥物不良反應,指臨牀試驗中發生的任何與試驗用藥可能有關的對人體有害或者非期望的反應。作爲抗腫瘤藥物,一般都有較高的“所有不良反應發生率”,其中更受臨牀醫生關注的爲3級及以上不良反應發生率及與藥物相關的嚴重不良反應(SAE)發生率。
君實生物解釋稱,相關媒體提到的“97.7%的所有不良反應發生率”來於特瑞普利單抗說明書的“HMO-JS001-II-CRP-01”研究,是一項開放、多中心、單臂、II期臨牀研究, 入組既往接受全身系統治療失敗後的不可手術或轉移性黑色素瘤患者,共納入128例患者,其定義爲:研究中,所有研究者判斷爲“肯定相關”“很可能相關”“可能相關”及“可能無關”和“無法判定”的所有級別的不良事件。
“HMO-JS001-II-CRP-01”研究不良反應主要包括如皮疹、乏力、食慾下降、 噁心、咳嗽、頭暈等1-2級(輕微)不良反應,3-4級不良反應發生率非常低,如下表所示:
君實生物進一步將公司產品與同類產品關鍵性註冊臨牀試驗安全性數據進行對比。根據特瑞普利單抗已獲批的《說明書》數據,“HMO-JS001-II-CRP-01”研究3級及以上不良反應發生率爲28.9%,與藥物相關的嚴重不良反應(SAE)的發生率爲11.7%,在同類藥物中均處於較低的水平,顯示出良好的安全性和耐受性。
關於特瑞普利單克隆抗體注射液的有效性,君實生物進一步指出,拓益(特瑞普利單抗)在同類產品中優異的療效性在第一個獲批適應症“既往標準治療失敗後的局部進展或轉移性黑色素瘤”的臨牀試驗中被充分論證:中位總生存期達到22.2個月,對比同樣在中國病人中進行的進口產品帕博利珠單抗的中位總生存期12.1個月,完全不亞於同類進口藥物,最終定價還打破了跨國藥企腫瘤免疫藥物的價格壟斷,一年用藥花費不到同類進口藥物海外定價的六分之一。
有數據支撐,也要用事實說話。
值得一提的是,特瑞普利單抗不僅獲得了國家藥監局的認可,同時也獲得了美國食品藥品監督管理局(簡稱“FDA”)的認可。至今,特瑞普利單抗在黏膜黑色素瘤、 鼻咽癌、軟組織肉瘤治療領域獲得FDA授予的3項孤兒藥認定。
孤兒藥認定是指,初步臨牀證據表明,該藥物在臨牀重要終點上可能比現有療法有實質性改善。特瑞普利單抗也是中國第一個獲得FDA突破性療法認定的自主研發抗PD-1單抗。
君實生物表示,以上臨牀研究結果表明,特瑞普利單抗作爲首款中國自主研發的抗PD-1抗體,在多項已完成的適應症中展現了優秀的有效性。拓益(特瑞普利單抗)在中國上市兩年以來,已經惠及了很多中國的黑色素瘤患者,從臨牀試驗走向臨牀實踐的過程中積累了大量真實世界的數據,從而印證了拓益在療效和安全性上的卓越表現。
財務數據顯示,2020年1-9月公司營業收入10.11億元,同比增長91.78%。產品銷售收入較去年同期增加1.95億元,同比增長37.09%。其中,特瑞普利單抗銷售收入6.89億元,同比增長30.91%。
JS016新冠中和抗體:
臨牀進展及合作一切順利
JS016爲君實生物與中國科學院微生物研究所合作開發的抗新冠病毒中和抗體藥物。關於JS016與禮來製藥的合作及臨牀研究則是公衆號文章質疑的第二點。
對此,君實生物在問詢回覆中詳細披露了JS016境外臨牀試驗的進展情況,截至回覆公告日,JS016在國內外的臨牀進展以及該項目和禮來製藥的合作均一切順利,不存在應披露而未披露事宜。JS016已順利完成中國、美國2項健康受試者I期研究。在國內,由公司發起的一項在新冠病毒感染者中評價JS016初步臨牀療效和安全性的國際多中心Ib/II臨牀研究仍按計劃進行。JS016同時正在美國開展1項由禮來製藥發起的聯合LY-CoV555的II期研究(BLAZE-1, NCT04427501)。
針對文章所稱“禮來製藥已宣佈停止了JS016相關的臨牀研究”,如今來看似乎有點“張冠李戴”。
君實生物回覆稱,根據www.clinicaltrials.gov公示信息,禮來製藥停止的ACTIV-3臨牀試驗是一項在COVID-19患者中開展的評估LY-CoV555聯合標準治療(瑞德西韋)對比安慰劑聯合標準治療(瑞德西韋)的III期臨牀試驗,該研究不涉及公司產品JS016,只涉及禮來製藥的另一箇中和抗體LY-CoV555。
研發團隊:技能全面、素質過硬
從產品安全性、有效性再到臨牀試驗,公衆號文章最終將矛頭指向君實生物的研發團隊。“一個大專生多過博士,一大半都是本科畢業的團隊”是否會影響公司的研發成色,拉低研發實力?
公告顯示,截至2020年11月12日,公司研發人員擁有本科及碩士學歷的研發人員佔 研發人員總數量的88.23%,構成了研發團隊的中堅力量;博士學歷的研發人員35名主要擔任公司各研發團隊的核心骨幹,是公司各項研發工作中的領軍人才,發揮着重要的引領作用。
而公司目前的研發人員中,有38人爲大專學歷,佔研發人員總數的6.13%。君實生物表示,這些員工大多從事研究工作的配合和支持工作,暫未直接參與核心的研發活動。參考同行業科創板公司,大專學歷的研發人員佔研發人員總數的比例大多在10-15%。
君實生物特別強調稱,在公司研發崗位上,不論學歷高低,低年資的技術人員可以在有經驗的專家指導下協助基礎性研發工作。員工學歷的高低與工作能力、實踐經驗也並不是絕對必然的聯繫,上述人員爲公司日常技術活動的開展也提供了較好的輔助。
編輯:徐銳














