理財週刊/生醫引爆新一波中國設廠潮
面對「中國製造2025」,生醫廠選擇直接到中國設廠,與中國廠商合資,佈局中國較久的F-康聯、F-康友、永信、國光、神隆、聯合骨科、邦特等,可望在「健康中國2020」加持下受惠。
文.李泰宏
正當因爲中國人工成本大幅上漲,包括臺廠在內亟欲將生產基地從中國移走時,卻有一個產業逆勢崛起,因應在地化需求,廠商積極思考將產線擴大到中國地區,就是中國未來龐大的醫療內需市場。根據統計,中國全國醫院中,有85%是屬於官方具有控制力的,換言之,醫院的採購都會依照中國官方的政策,而根據「中國製造2025」計劃,其中包括生物化學醫藥及高性能醫療器械等,都屬於優先採購國產品牌產品的領域,爲了避免訂單因爲非在中國當地生產而被迫出局,就算中國人工成本仍持續不斷成長,廠商仍有到中國擴產的規劃。
法人指出,從2001年到2015年,中國醫療設備市場的年複合成長率爲22.7%,且目前仍維持強勁成長趨勢。其中,新型高階醫療設備及醫療服務需求旺盛,相關公司營收之快速成長。值得注意的是,中國政府官方也呼籲增強對本地廠商的支持,要透過最大程度來實現醫療設備國產化,例如中國政府僅允許國內生產的蛋白質藥產品在中國銷售。
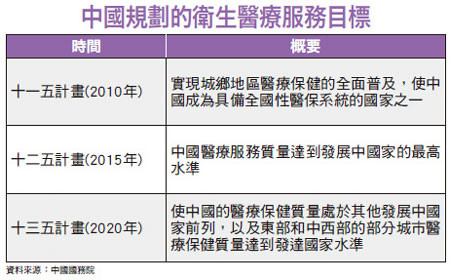
醫療設備國產化 優先用自有品牌
醫療器材廠環瑞醫(4198)表示,由於中國官方對於醫院仍有控制力,因此各家醫院高層在顧及自身利益下,沒有人會願意違反官方政策,率先採用國外進口品牌的醫療器材,就算其價格、品質都優於中國自有品牌,在外國品牌眼前就是有一道「看不到的天花板」。
中國官方要求醫院優先採用中國自有品牌醫療器材的另一個目的,其實就是提供中國醫療器材品牌有更大的試驗空間,因爲唯有經過不斷的試驗,自然就能提升技術。廠商坦言,中國民衆對於醫療的要求還沒有那麼高,只要能把病治好,就算病患本身可能被醫院及廠商用來當作實驗的對象,負面反應其實也並不會像其他國家民衆那麼激烈。
爲貫徹「中國製造2025」的目標,也爲了不能在中國市場缺席,近期不少臺廠陸續跟中國廠商簽署合作備忘錄,像是主打自有品牌人工關節的醫材廠聯合骨科(4129)就宣佈,與中國重量級醫療器材供應商山東新華集團達成協議,雙方在山東合資成立山東新華聯合骨科器材,聯合骨科董事長林延生表示,中國官方啓動「中國製造2025」政策,內容明定重大技術設備,包括高性能醫療器材在內,例如骨科植入物,到了2025年國產自有率將達70%,勢必衝擊進口商。
面對「中國製造2025」,生醫廠只能選擇直接到中國設廠,而與中國廠商合資,就是臺廠在面對中國政策下的應變方式。只不過,要到中國設廠也不是那麼容易,尤其生醫產業的要求更高,根據中國政府法令要求,新成立公司約需一年半到兩年才能取得生產資格,爲了搶得先機,預料近期還會有更多廠商陸續宣佈在中國擴產,或是與中國廠商合資設廠。
以聯合骨科的山東新華聯合骨科爲例,預計最快也要到2017年纔會開始投產,初期還是以代理聯合骨科的產品爲主,等到山東新華聯合骨科產線通過審覈可以開始自行生產後,纔會並行代理 及自有品牌業務,其中高階產品將代理聯合骨科自有品牌,中低階則由山東新華聯合骨科自有品牌爲主。
醫材廠就地生產 藥品廠結盟通路
就連即將在十二月十六日掛牌上櫃的醫療器材廠明基醫(4116),儘管集團在中國已有包括明基蘇州及明基南京等兩家醫院,較其他醫材廠已相對有利,但明基醫仍計劃在佳世達(2352)蘇州廠區取得用地,用來生產醫療器材,以搶攻中國市場。明基醫表示,由於醫療產品進入門檻高,且產品週期長,再加上醫療採各國獨立認證相當耗時,因此就地生產也將成趨勢。不只醫療器材廠亟思到中國設廠,就連藥品廠也陸續西進,與中國通路商進行策略合作,透過中國通路商的佈局,搶食商機,包括健喬(4116)子公司益得(6461)也宣佈跟中國醫藥行業第二大央企華潤賽科藥業簽訂策略聯盟合約,將益得的呼吸用藥帝舒滿MDI(定量噴霧器)授權給華潤賽科中國獨家銷售,搶攻PM2.5商機。
而且不僅醫療器材認證時間長,外國藥品要取得中國藥證的時間也很久,華潤賽科藥業總經理吳文多就指出,中國對於藥品的審批時間大約需要三到四年,不過近期速度有變快,預估帝舒滿MDI有機會在二到三年就取得上市核可,2018年應該就可以在中國上市。由此可見,到中國設廠已經成爲臺灣生醫廠必須要走的一條路了。
臺灣神隆(1789)共同創辦人馬海怡表示,相較於其他產業,生醫產業是最具地區性的,由於每個國家都有自己的不同標準,因此要打入當地市場,基本上選擇就地生產已經逐漸成爲趨勢,而且產線蓋好之後,認證時間又不一,對生醫廠來說,每到一個國家就等於重新開始。
目前臺廠佈局中國較久的生醫廠,包括F-康聯(4144)、F-康友(6452)、永信(3705)、國光(4142)、神隆、聯合骨科、邦特(4107)等等,可望在「健康中國2020」政策加持下受惠。
神隆常熟廠獲認證 F-康友稅率減免
臺灣神隆中國常熟廠日前順利通過美國食品藥物管理局(FDA)查廠,並以零缺失(Zero Form 483)的表現獲得認證,包括軟、硬體設備均符合國際優良藥品製造(cGMP)規範。臺灣神隆表示,常熟廠是中國國家食品藥品監督管理總局(CFDA)公佈新版GMP之後,首批依循相關標準建造的原料藥廠,通過FDA認證後,未來歐美大藥廠需要在中國境內符合環安衛質量法規的代工夥伴,公司即可搶奪先機,並可扮演中國與歐美客戶之間的關鍵角色。
專攻中國大型輸液市場的F-康友,其營運主體六安華源製藥經安徽省科技廳編列至高新技術企業初審及專家審查名單,日前已通過告示,並無人提出異議,只要正式通過公文發送,即可確認從今年起,連續三年都享有高新企業稅率減免,稅率將由二五%降到一五%。另外F-康友也積極擴充輸液生產線,預計將增加兩條軟袋輸液生產線,產能較目前增加一倍,同時也將新增四條塑瓶輸液生產線,塑瓶產能將可增加兩倍。(文未完)
【詳細內容請參閱最新一期《理財週刊》第798期www.moneyweekly.com.tw,行動版APP下載http://tinyurl.com/ngpv39u。尊重智慧財產權 如需轉載請註明出處來源。】














